Großer odontogener Tumor im Kongo
Gottfried Lemperle, Christoph Sachs, Katja Kassem-Trautmann, Carsten Schröder, Jörg Kalla
Das 4. Interplast Hospital in Goma, Kongo
Gottfried Lemperle
Projekt eines 4. Interplast-Hospitals in Goma, Kongo
Gottfried Lemperle
Extreme Tumoren der Haut und Verbrennungs-Kontrakturen im Kongo
Katja Kassem-Trautmann, Plastische Chirurgie Zug, Schweiz
Gleichzeitige Rekonstruktion der gesamten Ober- und Unterlippe während eines humanitären chirurgischen Einsatzes in Afrika
Arthur Charpentier1, Gottfried Lemperle2
Bericht 6
###
Bericht 7
###
Bericht 8
###

1Plastischer Chirurg, Wolfsgangstr. 64, 60322 Frankfurt am Main. Germany
2Abteilung für Plastische Chirurgie, Martin Luther Hospital, 14193 Berlin, Germany
3Plastischer Chirurg, Zug, Schweiz
4Abteilung für Anästhesie, Hospital Horgen, Schweiz
5Schwarzwald-Baar Klinikum Institut für Pathologie, Germany
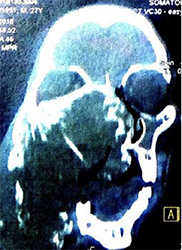
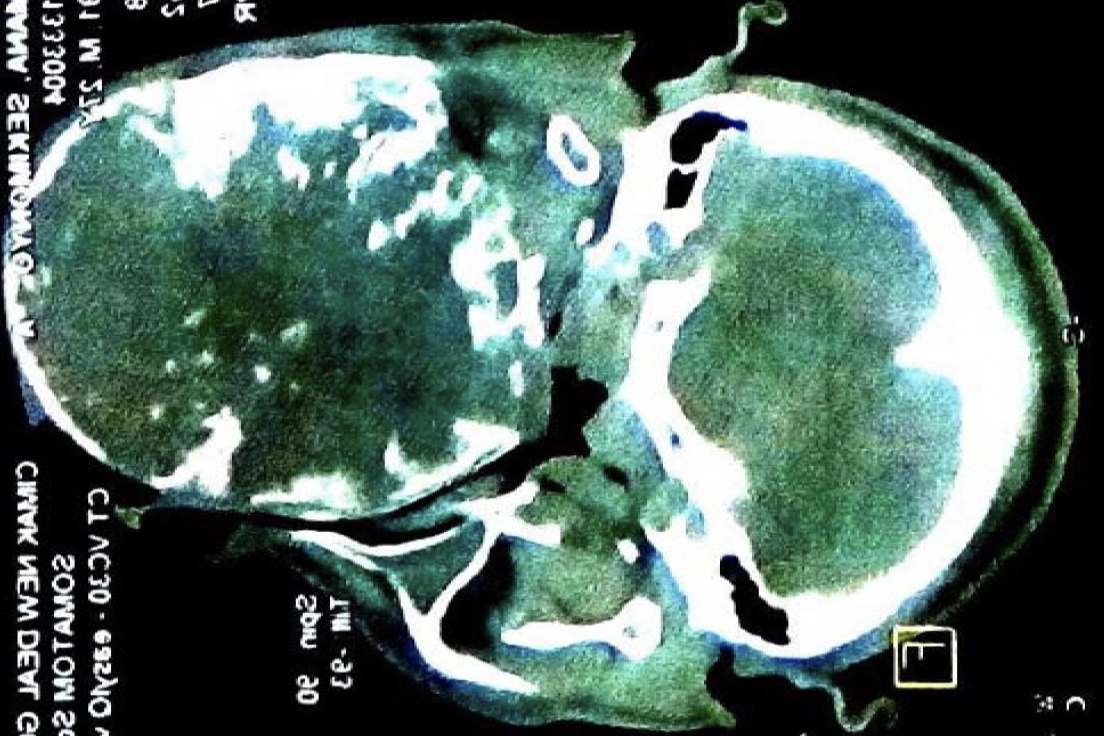
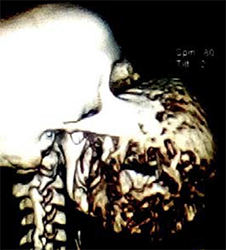
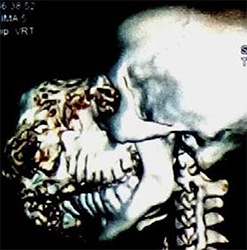
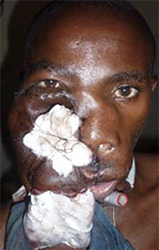
Ein gut entwickelter 26-jähriger Patient bemerkte angeblich erstmals vor drei Jahren einen Tumor in seinem rechten Oberkiefer (Abbildungen 1, 2). Er sprach undeutlich, aber verständlich. Bilder von einem Siemens Somatoma® in Goma, Demokratische Republik Kongo (DRC) (Abbildungen 3 und 4), und CT zeigten eine Verdrängung des Gewebes von allen Seiten, die 3D-Rekonstruktion zeigte auch knöcherne Strukturen innerhalb des Tumors (Abbildungen 5 und 6). Radiologen vermuteten ein Ameloblastom oder ein Knochensarkom. Rückblickend zeigten die Bilder jedoch auch die klassischen radiologischen Merkmale eines odontogenen Myxoms.
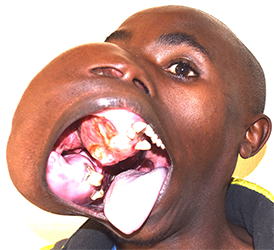
in dem sich die knöchernen Trabekel im rechten Winkel in einer multilokulären Strahlendurchlässigkeit schneiden [3].
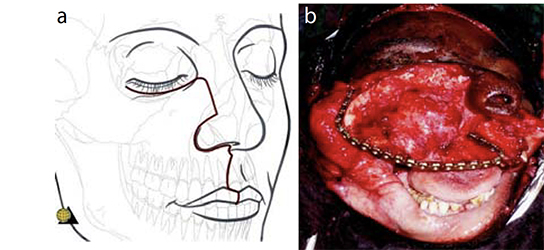
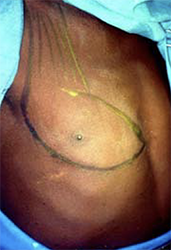
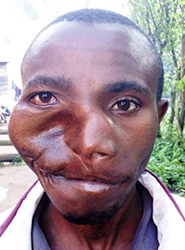
Um einen osteo-myo-kutanen Pectoralislappen zu bilden und zumindest einige Teile des Gaumens des Patienten zu rekonstruieren, wurde eine Tracheotomie durchgeführt. Die Resektion des großen Tumors mit einer elektrischen Säge war relativ einfach und verursachte keinen größeren Blutverlust. Der nun fehlende Oberkiefer wurde suboptimal mit einer Metallplatte rekonstruiert, die bogenförmig an beiden Jochbeinen befestigt wurde (Abbildungen 7). Die fünfte Rippe, die mit dem gestielten Gefäßlappen des Brustmuskels angehoben wurde, wurde innen in vier Abschnitte zersägt und bogenförmig mit Schrauben an der Metallplatte befestigt, wobei sie von Muskelgewebe umgeben blieb [4].
Der anhängende Hautlappen, der die Brustwarzenregion einschloss (die Brustwarze wurde wieder eingepflanzt), reichte für einen spannungsfreien Verschluss des „neuen“ Gaumens aus. Eine innere Auskleidung der Nasenseite kann oft weggelassen werden, da in den kommenden Monaten lebende Epithelzellen, die sich von der Nasenschleimhaut ablösen, die „raue Oberfläche“ der Atemwege voraussichtlich epithelialisieren werden. Um eine optimale Gefäßanbindung des Muskellappens von kranial zu ermöglichen, wurde die weit überdehnte Wangenhaut von außen mit einem Bolus-Druckverband auf den Muskel gedrückt (Abbildungen 8).
Der postoperative Verlauf war ohne Komplikationen. Der örtliche Chirurg entfernte den Bolusverband nach 6 Wochen von der Wange unter der Bedingung, dass der nach oben gerichtete Brustmuskel ausreichend Gefäße von der gut durchbluteten Wangenhaut erhielt. Weitere 10 Tage später durchtrennte er den osteo-myo-kutanen Brustmuskel und entsorgte ihn.
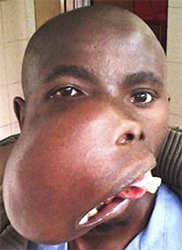
In den ersten postoperativen Monaten war noch keine sichtbare Erholung der extrem überdehnten Gesichtsnervenäste in der rechten Wange zu erkennen (Abbildung 9). Der Patient verließ das Krankenhaus unzufrieden, da seine Sprache nun noch undeutlicher war und der eines unbehandelten Gaumenspaltenpatienten ähnelte. Leider verschwand er im kongolesischen Busch und kehrte nie zurück. Als wir diesen Artikel schrieben, kontaktierten wir „Heal Africa“, das Krankenhaus, in dem ein Jahr vor der Operation ein kostenloses MRT und CT durchgeführt worden war, aber sie konnten den Patienten nicht ausfindig machen. Daher können wir nicht über seine Sprache, die Erholung seines überdehnte Gesichtsnervs oder eine postoperative Gesichtsröntgenaufnahme berichten. Wegen seines erschreckenden Aussehens wurde er „der Hippoman“ genannt.
Der doppelt faustgroße Tumor hatte beim Durchschneiden ein polymorphes Erscheinungsbild aus gelatineartigen Weichteilen und festen Knötchen, Knochentrabekeln und Blutungen. Da der Augenhöhlenboden von unten korrodiert zu sein schien, wurde eine 3 x 2 x 1 cm große Biopsie aus dem festen weißen Rand entnommen, um ein Sarkom auszuschließen. Verständlicherweise konnte der örtliche Pathologe keine Epithelstrukturen erkennen. Die histologische Untersuchung in Deutschland ergab die folgenden verkürzten Befunde.
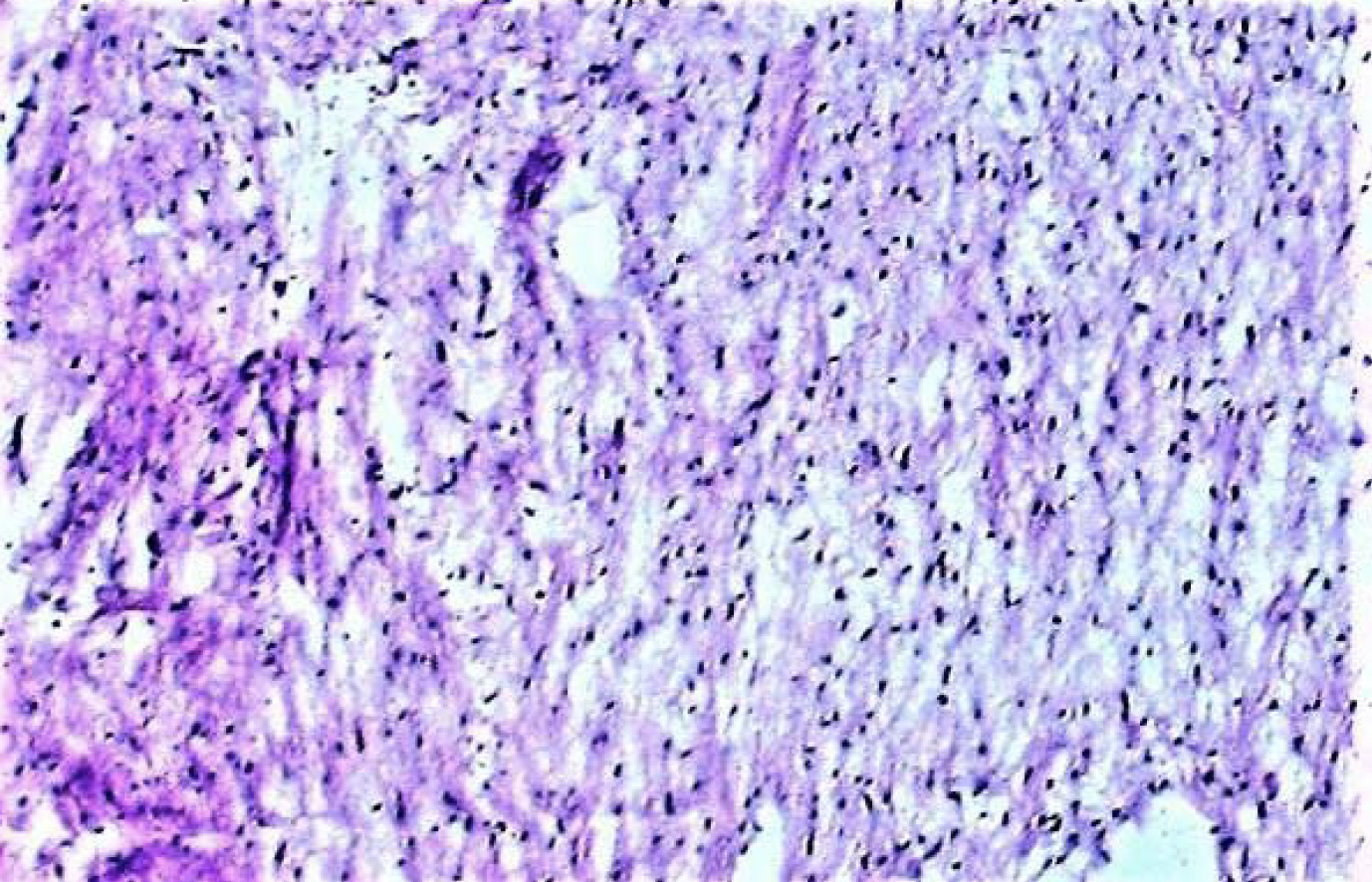
„Überwiegend aufgelockertes, kollagenreiches Gewebe mit optisch leeren Räumen wie bei Ödemen. Die Mehrheit wies eine geringe bis leicht erhöhte Zellularität mit niedrigen polymorphen Kernen von Fibroplasten mit nur sporadisch erkennbaren Nukleolen auf (Abbildung 11). Keine Mitosen. Vereinzelt kapilläre Proliferate. Lipomatöse Strukturen sind nicht erkennbar. Fokales verkalktes Gewebe mit gewebten Knochen und einzelnen angedeuteten lamellaren Strukturen. Es finden sich wiederholt lockere Aggregate lymphoider Zellen, die sich mit neutrophilen segmentalen Granulozyten vermischen, sowie einzelne Erythrozytenextravasate. Einzelne, etwas dichtere Bündel von Kollagenfasern (Abbildung 12)“.
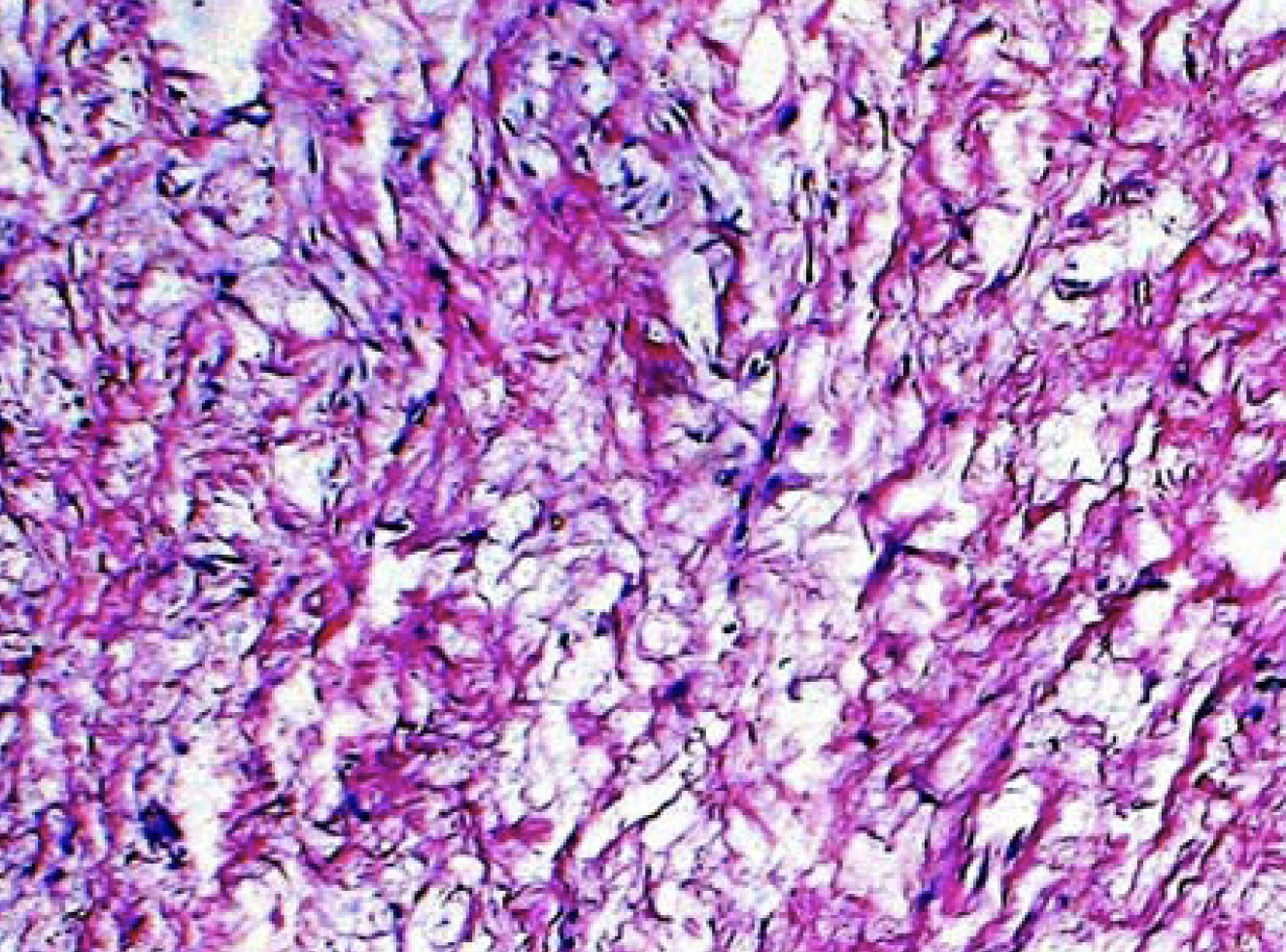
Diagnose: Je nach klinischem Erscheinungsbild sind die Befunde in hohem Maße mit einem odontogenen Myx
In den Hauptstädten Afrikas südlich der Sahara gibt es vielleicht eine Handvoll Mund-, Kiefer- und Gesichtschirurgen und plastische Chirurgen, die Erfahrung mit dieser Art von großen Tumoren haben. Der Pectoralis-major-Lappen wurde erstmals 1979 von Ariyan beschrieben [7]. Es handelt sich um einen gestielten myokutanen Insel-Lappen, der in den letzten 40 Jahren zum Standard für die Weichteilrekonstruktion in der Kopf- und Halschirurgie geworden ist.
Im Westen galt der beschriebene osteo-myokutane Brustlappen nicht als Hexenwerk und wurde größtenteils durch einen freien Unterarmlappen oder sogar osteo-myokutane Schulterblattlappen ersetzt [4], die in unserer Frankfurter Abteilung für Plastische Chirurgie in den frühen 1980er Jahren zur Deckung verheerender Gesichtsdefekte nach Noma-Infektionen bei Kindern in der Subsahara-Region verwendet wurden. Im Vergleich zu lokalen Lappen haben sie den Vorteil, dass sie die Integrität der umgebenden Gesichtshaut nicht beeinträchtigen.
Eine klinische Diagnose ohne Biopsiebefund eines Pathologen ist für den Chirurgen immer eine Herausforderung. Ein chirurgischer Eingriff ist notwendig, um ein zukünftiges Ersticken zu verhindern. Die Gutartigkeit ist jedoch aufgrund der klaren Grenzen des Tumors schnell offensichtlich – und wenn es innerhalb des Tumors bösartige Tumore gibt, beeinflussen diese das Ergebnis nicht.
Auf einem Kongress in Kapstadt [8] im Jahr 1998 wurden 4.384 Fälle von odontogenen Tumoren (OT) aus dem subsaharischen Afrika vorgestellt: 86,9 % waren Ameloblastome, 6,9 % keratokystische OT, 4,9 % myxomatöse OT und 1,4 % wiesen eine maligne Entartung auf.
Ähnliche Zahlen wurden 2016 in Nigeria veröffentlicht [9]. Präoperative Biopsien waren zum Zeitpunkt der Operation selten vorhanden und die postoperative Pathologie war nicht immer eindeutig. D. h., komplexe OT war in dieser Hinsicht die zweithäufigste Art von OT nach Ameloblastomen (was war die häufigste Art??).
Eine Online-Recherche ergab, dass in Entwicklungsländern klinisch ähnlich aussehende riesige Gesichtstumoren diagnostiziert wurden, die als „kraniofaziale fibröse Dysplasie“ bezeichnet werden und heute als Mutation des Gens GNAS1 auf Chromosom 20 gelten [10]. Eine Vielzahl von Subtypen odontogener Tumoren kann als Differentialdiagnose in Betracht gezogen werden [3], am häufigsten, wenn begrenzte Biopsien von „gemischten“ Tumoren verfügbar sind [11]. Für den Chirurgen ist dies jedoch eher eine wissenschaftliche Debatte mit geringer Relevanz für den Patienten oder das Ergebnis.
Afrika ist heute die Heimat von 1,3 Milliarden Menschen; bis 2050 wird sich diese Zahl voraussichtlich verdoppeln. Die meisten von ihnen werden ihre Länder verlassen und nach Norden fliehen müssen. Da die medizinische Versorgung mit dieser Bevölkerungsexplosion nicht Schritt halten kann, werden wir in Europa oder bei unseren humanitären Einsätzen viel häufiger mit großen odontogenen Tumoren konfrontiert sein. Da die Strahlentherapie bei fast allen odontogenen Tumoren die einzige Option ist, ist eine korrekte Diagnose durch den Pathologen klinisch relevant, da 1,4 % der bösartigen Tumoren identifiziert werden können [5], für die eine postoperative Bestrahlung in Betracht gezogen werden muss. Goma, eine Stadt mit 2 Millionen Einwohnern, verfügt über keine Einrichtungen für eine postoperative Bestrahlung.
Der Chirurg muss die Gutartigkeit eines Tumors anhand des klinischen Wachstums und des makroskopischen Schnittbildes während der Operation bestimmen, um bei Bedarf weitere Kontrollen oder Therapien einzuleiten. Die anfängliche Verdachtsdiagnose entspricht nicht immer dem Grundsatz „Wenn draußen Hufe klappern, stammen sie höchstwahrscheinlich von einem Pferd und nicht von einem Zebra“ (zugeschrieben an J. F. Dieffenbach).
Eine klinische Diagnose ohne Biopsiebefund eines Pathologen ist für den Chirurgen immer eine Herausforderung. Ein chirurgischer Eingriff ist notwendig, um ein zukünftiges Ersticken zu verhindern. Die Gutartigkeit ist jedoch aufgrund der klaren Grenzen des Tumors schnell offensichtlich – und wenn es innerhalb des Tumors bösartige Tumore gibt, beeinflussen diese das Ergebnis nicht.
Auf einem Kongress in Kapstadt [8] im Jahr 1998 wurden 4.384 Fälle von odontogenen Tumoren (OT) aus dem subsaharischen Afrika vorgestellt: 86,9 % waren Ameloblastome, 6,9 % keratokystische OT, 4,9 % myxomatöse OT und 1,4 % wiesen eine maligne Entartung auf.
Große Unregelmäßigkeiten nach einer Gesichts-Tumorresektion werden heute mit freien Kompositlappen aus dem Unterarm oder Schulterblatt abgedeckt. Bei humanitären Einsätzen in Afrika gibt es jedoch kein Operationsmikroskop und nur wenige Chirurgen sind es gewohnt, Anastomosen mit Hilfe von Lupen durchzuführen. Daher ist eine eher altmodische, aber sichere und zuverlässige Option die Verwendung eines gestielten Pectoralis-Insel-Lappens, um die meisten großen Gesichtsdefekte bei der Rekonstruktion eines verlorenen Gaumens abzudecken und um fehlgeschlagene Lappen zu ersetzen [4].